河南美凯生物科技有限公司
总 机:0395-3333801
客 服:0395-3333802
人事部:15303957929
邮 箱:3176821628@qq.com
邮 编:462000
网 址:www.maincare.cn
地 址:漯河市源汇区创业路与南环路西北角
周边公交:126、202、102路车
医疗器械注册与备案
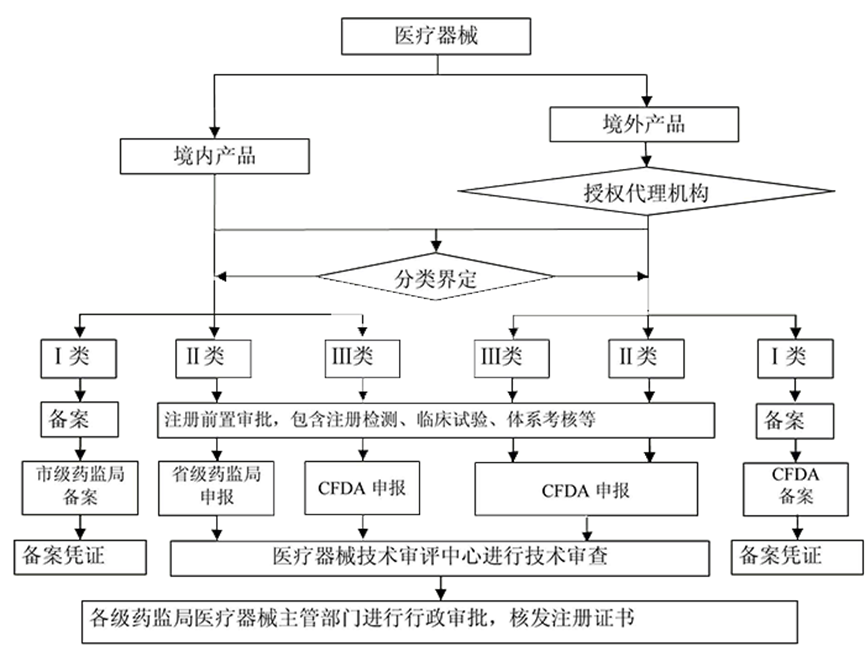
说明:
1.1港澳台属于境外。
1.2进口医疗器械:
1.2.1应当在申请人或者备案人注册地或者生产地址所在国家(地区)已获准上市销售。
1.2.2申请人或者备案人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人或者备案人需提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
1.2.3境外申请人或者备案人应当通过其在中国境内设立的代表机构或者指定中国境内的企业法人作为代理人,配合境外申请人或者备案人开展相关工作。1.3境内注册的委托生产:
1.3.1如按照创新医疗器械特别审批程序审批,样品委托其他企业生产的,应当委托具有相应生产范围的医疗器械生产企业
1.3.2不属于按照创新医疗器械特别审批程序审批的,样品不得委托其他企业生产。
1.4质量管理体系
医疗器械注册申请人和备案人应当建立与产品研制、生产有关的质量管理体系,并保持有效运行。
进口第二类、第三类医疗器械,总局技术审评机构认为有必要进行质量管理体系核查的,通知国家食品药品监督管理总局质量管理体系检查技术机构根据相关要求开展核查,必要时技术审评机构参与核查。1.5周期:
申报资料转交至技术审评机构:自受理之日起3个工作日。
技术审评:第二类医疗器械注册(60个工作日内);第三类医疗器械注册(90个工作日)。需要外聘专家审评、药械组合产品需与药品审评机构联合审评的,所需时间不计算在内,技术审评机构应当将所需时间书面告知申请人。
决定:在技术审评结束后20个工作日
注册证送达:自作出审批决定之日起10个工作日。
2.1属于新《分类目录》里的可直接查询,新《分类目录》不包括体外诊断试剂。
2.3新研制的尚未列入分类目录的:
医疗器械临床试验应当在两个或者两个以上医疗器械临床试验机构(“医疗器械临床试验机构备案管理信息系统”)中进行。
生产许可证有效期为5年
流程
境内第二类、第三类注册质量管理体系核查,由省、自治区、直辖市食品药品监督管理部门开展,其中境内第三类医疗器械注册质量管理体系核查,由国家食品药品监督管理总局技术审评机构通知相应省、自治区、直辖市食品药品监督管理部门开展核查,必要时参与核查。省、自治区、直辖市食品药品监督管理部门应当在30个工作日内根据相关要求完成体系核查。
类别划分
2.2新《分类目录》不包括组合包类产品,组合包类产品的类别应当依据《医疗器械分类规则》
依照本条例有关第三类医疗器械产品注册的规定直接申请产品注册。直接申请第三类医疗器械注册的,国家食品药品监督管理总局按照风险程度确定类别。境内医疗器械确定为第二类的,国家食品药品监督管理总局将申报资料转申请人所在地省、自治区、直辖市食品药品监督管理部门审评审批;境内医疗器械确定为第一类的,国家食品药品监督管理总局将申报资料转申请人所在地设区的市级食品药品监督管理部门备案。
依据分类规则判断产品类别并向国务院食品药品监督管理部门申请类别确认后依照本条例的规定申请注册或者进行产品备案。
申请资料
产品风险分析资料;
产品技术要求;
产品检验报告;
临床评价资料(需要进行临床试验的,提交的临床评价资料应当包括临床试验方案和临床试验报告。)
产品说明书及标签样稿;
与产品研制、生产有关的质量管理体系文件;
证明产品安全、有效所需的其他资料。
境外注册人企业资格证明文件、产品境外上市销售证明文件、境外企业指定境内代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
检测
备案:产品检验报告可以是备案人的自检报告;临床评价资料不包括临床试验报告,可以是通过文献、同类产品临床使用获得的数据证明该医疗器械安全、有效的资料,不需进行临床试验。
注册:依据产品技术要求对相关产品进行注册检验。(产品技术要求主要包括医疗器械成品的性能指标和检验方法,其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。)
临床试验:部分二、三类医疗器械可免于临床试验,详情见相关文档。 临床试验前,申办者应当完成试验用医疗器械的临床前研究,包括产品设计(结构组成、工作原理和作用机理、预期用途以及适用范围、适用的技术要求)和质量检验、动物试验以及风险分析等,且结果应当能够支持该项临床试验。质量检验结果包括自检报告和具有资质的检验机构出具的一年内的产品注册检验合格报告。对于其中检验机构的一年内的产品注册检验合格报告,在多中心开展临床试验的情形,是以检验报告出具时间至临床试验牵头单位伦理审查通过时间计算一年有效期;在非多中心开展临床试验的情形,是以检验报告出具时间至每家临床试验机构伦理审查通过时间分别计算一年有效期。
开展非高风险类医疗器械临床试验,应当按向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。开展医疗器械临床试验,申办者与每家临床试验机构签订协议或合同后,均可向申办者/代理人所在地省级食品药品监督管理部门备案。备案后,即可开展临床试验。同一个临床试验项目多次备案时,申办者应当同时提供前期已取得的所有备案表。
具有高风险的第三类医疗器械(见相关文档)的临床试验需向总局进行临床实验的申请,审批后方可进行。
高风险的第三类医疗器械的临床试验的审批申请:总局受理医疗器械临床试验审批申请后,应当自受理申请之日起3个工作日内将申报资料转交医疗器械技术审评机构。技术审评机构应当在40个工作日内完成技术审评。国家食品药品监督管理总局应当在技术审评结束后20个工作日内作出决定。
尚未列入医疗器械检验机构承检范围的医疗器械,由相应的注册审批部门指定有能力的检验机构进行检验。
未列入免于进行临床试验的医疗器械目录的产品,通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的,申请人可以在申报注册时予以说明,并提交相关证明资料。
医疗器械产品应当符合医疗器械强制性国家标准;尚无强制性国家标准的,应当符合医疗器械强制性行业标准。
生产
一类医疗器械:向所在地设区的市级人民政府食品药品监督管理部门备案并提交其证明资料。
二类、三类医疗器械:向所在地省、自治区、直辖市人民政府食品药品监督管理部门申请生产许可并提交证明资料以及所生产医疗器械的注册证。
证明资料
(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;
(二)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;
(三)有保证医疗器械质量的管理制度;
(四)有与生产的医疗器械相适应的售后服务能力;
(五)产品研制、生产工艺文件规定的要求。
受理生产许可申请的食品药品监督管理部门应当自受理之日起30个工作日内对申请资料进行审核。
医疗器械生产企业应当定期对质量管理体系的运行情况进行自查,并向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交自查报告。
注册证
医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。
